Secondary antibodies bind to primary antibodies, which in turn recognize a protein of interest. Secondary antibodies are often conjugated to fluorophores or enzymes for protein detection and visualization in applications such as western blot, immunohistochemistry, immunocytochemistry, flow cytometry and ELISA.
We offer a comprehensive catalog of over 2,000 conjugated and unconjugated secondary antibodies for fluorescent, chemiluminescent or colorimetric detection of primary antibodies.
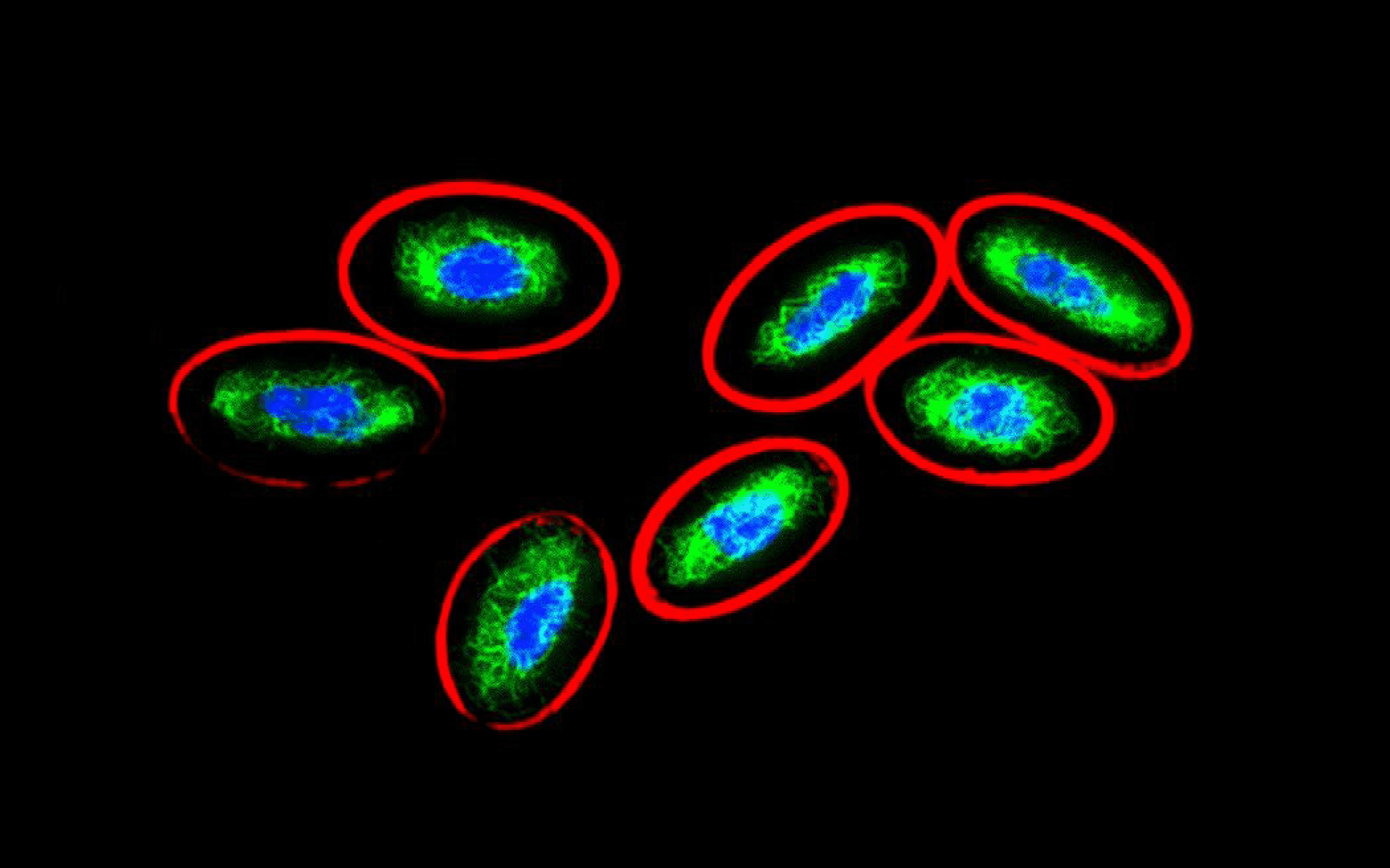
AP catalyzes the dephosphorylation of substrates to produce a colored product or light. Even more sensitive than HRP, AP-conjugated antibodies are recommended for IHC, ELISA and western blot.
Biotin-labeled antibodies allow for signal amplification, making them ideal for low abundance protein detection. Biotin binds with high affinity to avidin and streptavidin, which in turn can be conjugated to enzymes such as HRP.
HRP uses hydrogen peroxide to oxidize substrates to produce a colored product or light. HRP is highly stable, and is commonly used to amplify signals in IHC, ELISA and western blot.
Unconjugated secondary antibodies are ideal for custom conjugations, such as for complex flow cytometry panel design. They can also be used in ELISA to detect other antibodies, or as an extra layer of amplification in multiple applications.