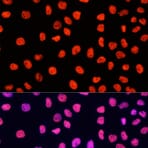
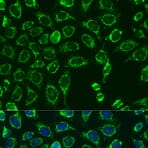
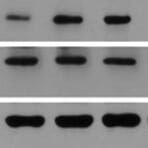
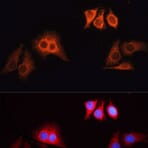
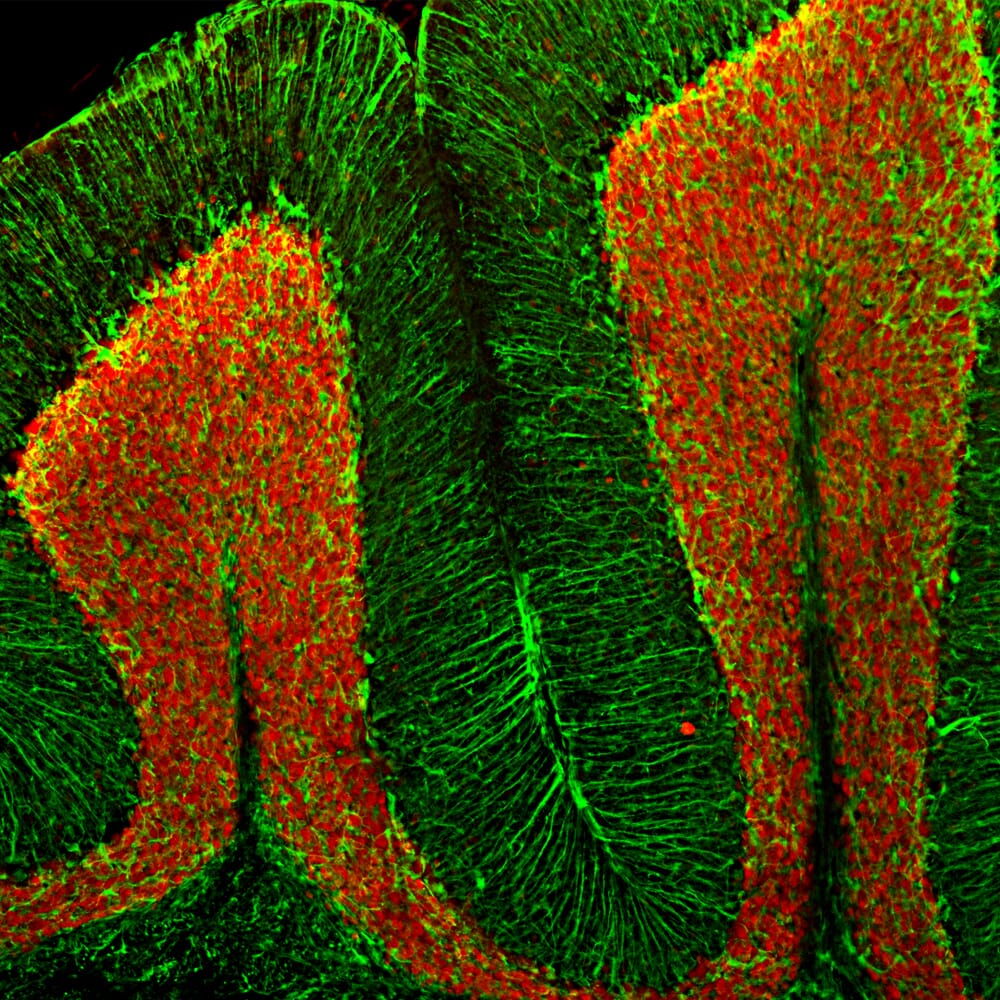
Les enzymes, comme la peroxydase de raifort (HRP, de l'anglais « horseradish peroxidase » ) ou la phosphatase alcaline (AP), peuvent se conjuguer à un anticorps via des liaisons covalentes. Les anticorps conjugués aux enzymes sont utilisés en conjonction avec un substrat, fluorogène, colorimétrique ou chimioluminescent, pour créer un signal détectable. Le substrat soluble non détectable est converti par l'enzyme en une forme détectable (et normalement insoluble). Les anticorps conjugués aux enzymes permettent l'amplification du signal; comme l'enzyme est capable de convertir de nombreuses molécules du substrat, la durée pendant laquelle la réaction peut se poursuivre détermine la force du signal.
Peroxydase de Raifort
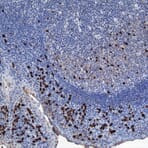
La peroxydase de raifort (HRP) est une enzyme dérivée de la racine d'Armoracia rustiqueana (alias la plante de raifort) qui est couramment utilisée comme protéine rapporteur. Les anticorps secondaires conjugués au HRP peuvent être utilisés pour la détection colorimétrique, où le HRP catalyse la conversion d'un substrat chromogène en un précipité coloré, ou pour la détection chimioluminescente, où le HRP produit un signal en oxydant un substrat chimiluminescent en une forme qui émet de la lumière.
Plusieurs molécules de HRP peuvent se lier à un seul anticorps secondaire, en tant que tel, des anticorps secondaires conjugués à HRP peuvent être utilisés pour améliorer le signal et permettre la détection de protéines exprimées à de faibles niveaux. HRP a également un taux de rotation élevé qui permet aux anticorps secondaires conjugués à HRP de générer un signal fort en peu de temps (souvent en moins de cinq minutes).
Phosphatase Alcaline
Les anticorps secondaires conjugués à la phosphatase alcaline (AP) sont couramment utilisés pour ELISA et western blot. Ils sont également parfois utilisés pour l'immunohistochimie, mais leur grande taille peut limiter la pénétration dans les tissus. Il convient de noter que, alors que le HRP génère un signal maximal rapidement, souvent en moins de cinq minutes, le signal de l'AP augmente progressivement et culmine à environ une heure. AP génère un signal très stable qui peut durer plusieurs jours; cela est particulièrement utile si plusieurs expositions sont nécessaires, en particulier sur une question de jours.
Vous essayez de choisir entre HRP et AP pour votre blot ?
Utilisez notre tableau ci-dessous pour vous aider à prendre la décision.
| AP | HRP |
| Sensible | Sensible |
| Signal de longue durée (24-48 heures) | Signal max rapide (~ 5 minutes) |
| Utile pour les expositions multiples | Inhibé par les azides |
| Inhibé par les tampons au phosphate | Économique |
Biotine
La biotine est une petite vitamine B soluble dans l'eau qui peut être liée par l'avidine, la Neutravidine et la streptavidine avec une affinité élevée. En raison de sa petite taille, la liaison avec la biotine n'affecte généralement pas l'activité biologique d'une protéine. De multiples molécules de biotine peuvent se conjuguer à un seul anticorps secondaire, en tant que tel, des anticorps secondaires conjugués à la biotine peuvent être utilisés pour améliorer le signal et permettre la détection de protéines exprimées à de faibles niveaux. La visualisation se produit par l'interaction biotine / streptavidine par laquelle la streptavidine est liée à HRP ou à une sonde fluorescente. En utilisant un anticorps secondaire conjugué à la biotine, le même anticorps secondaire peut être utilisé dans de multiples applications simplement en changeant la streptavidine utilisée.